Նատրիումի ամիդ
քիմիական միացություն
| Այս հոդվածն աղբյուրների կարիք ունի։ Դուք կարող եք բարելավել հոդվածը՝ գտնելով բերված տեղեկությունների հաստատումը վստահելի աղբյուրներում և ավելացնելով դրանց հղումները հոդվածին։ Անհիմն հղումները ենթակա են հեռացման։ |
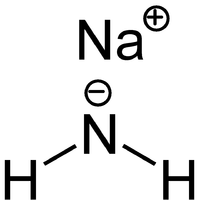
Նատրիումի ամիդ, անօրգանական նյութ՝ NaNH2 բանաձևով, ամոնիակի ածանցյալը։ Իրենից ներկայացնում է պինդ նյութ, ռեակցիայի մեջ է մտնում ջրի հետ։ Օգտագորսծվում է օրգանական սինթեզներում։
| Նատրիումի ամիդ | |
|---|---|
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | նատրիումի ամիդ |
| Քիմիական բանաձև | H₂NNa |
| Ռացիոնալ բանաձև | NaNH2 |
| Մոլային զանգված | 6,5E−26 կիլոգրամ[1] գ/մոլ |
| Խտություն | 1,37 գ/սմ³ գ/սմ³ |
| Ջերմային հատկություններ | |
| Հալման ջերմաստիճան | 210 °C °C |
| Եռման ջերմաստիճան | 400 °C °C |
| Մոլյար ջերմատարողություն | 66,15 Ջ/(մոլ•Կ) |
| Գոյացան էնթալպիա | −118,8 կՋ/մոլ կՋ/մոլ |
| Քիմիական հատկություններ | |
| Դասակարգում | |
| CAS համար | 7782-92-5 |
| PubChem | 24533 |
| EINECS համար | 231-971-0 |
| SMILES | [NH2-].[Na+] |
| ЕС | 231-971-0 |
| ChEBI | 22940, 21111834 |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Նկարագրությունը
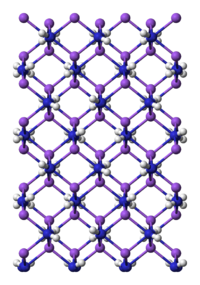
խմբագրելՆատրիումի ամիդը (NaNH2) իրենից ներկայացնում է սպիտակ բյուրեղային նյութ։ Արտադրական ձևերը մոխրագույն են՝ արտադրական պրոցեսից առաջացող ոչ մեծ քանակի մետաղական երկաթի պատճառով։ Նատրիումի ամիդը անկայուն միացություն է, ուժեղ վերականգնիչ և ունի ջուր խլող հատկություն։ Նատրիումի ամիդի հետ աշխատելիս պետք է զգուշություն ցուցաբերել։
Ստացումը
խմբագրել- Նատրիումի հիդրիդի և ամոնիակի փոխազդեցությունը 350 °C ջերմաստիճանում
- Նատրիումի օքսիդի և հեղուկ ամոնիակի փոխախազդեցությունը −50 °C ջերմաստիճանում
Կիրառությունը
խմբագրելՆատրիումի ամիդը օգտագործվում է նատրումի ցիանիդի՝ NaCN, C16H10N2O2, սուլֆիդինի, A վիտամինի և այլ նյութերի սինթեզում. Բացի այդ նատրիումի ամիդը օգտագործվում է ազիդների սինթեզում՝ NaNH2 + N2O → NaN3 + H2O։