Ածխածնի մոնօքսիդ
Ածխածնի մոնօքսիդ, շմոլ գազ (CO), ածխածնի և թթվածնի բինար միացություն, որտեղ ածխածինն ունի +2 օքսիդացման աստիճան։ Անգույն, անհամ, անհոտ թունավոր գազ։
| Ածխածնի մոնօքսիդ | |
|---|---|
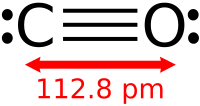 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | ածխածնի մոնօքսիդ |
| Ավանդական անվանում | շմոլ գազ |
| Քիմիական բանաձև | CO |
| Ֆիզիկական հատկություններ | |
| Ագրեգատային վիճակ | անգույն գազ |
| Մոլային զանգված | 4,6E−26 կիլոգրամ գ/մոլ |
| Խտություն | 0,00125 գ/սմ³ գ/սմ³ |
| Իոնիզացման էներգիա | 14,01 ± 0,01 Էլեկտրոն-վոլտ[1][2] կՋ/մոլ |
| Ջերմային հատկություններ | |
| Հալման ջերմաստիճան | −337 ± 1 ℉[1] և −205 °C[2] °C |
| Եռման ջերմաստիճան | −313 ± 1 ℉[1] և −191,5 °C[2] °C |
| Գոյացան էնթալպիա | -110,52 կՋ/մոլ |
| Գոլորշու ճնշում | 35 ± 1 մթնոլորտ[1] |
| Քիմիական հատկություններ | |
| Դիպոլ մոմենտ | 3,7E−31 Կլ·մ[2] |
| Դասակարգում | |
| CAS համար | 630-08-0 |
| PubChem | 281 |
| EINECS համար | 211-128-3 |
| SMILES | [C-]#[O+] |
| ЕС | 211-128-3 |
| RTECS | FG3500000 |
| ChEBI | 275 |
| IDLH | 1380 ± 10 mg/m³[1] |
| ԳՀՀ պատկերագրեր |  |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Մոլեկուլի կառուցվածք
խմբագրելԱծխածինը և թթվածինը կապված են մեկ եռակի կապով, ինչպես ազոտի մոլեկուլը, դրա համար էլ նրանք հատկություններով նման են։ Համաձայն մոլեկուլային օրբիտալների մեթոդի CO-ի ոչ գրգռված մոլեկուլի էլեկտրոնային կոնֆիգուրացիան կարելի է արտահայտել σ2Oσ2zπ4x, yσ2C. ձևով։ Եռակի կապը առաջացել է σ կապով, որը կազմվել է σz էլեկտրոնային զույգի հաշվին, իսկ նույն մակարդակի վրա առաջացած երկու πx, y էլեկտրոնները առաջացնում են երկու π կապերը։ Եռակի կապի շնորհիվ CO-ի մոլեկուլը շատ ամուր է (1069 կՋ/մոլ) և փոքր միջմիջուկային հեռավորություն (dC≡O=0, 1128 նմ կամ 1, 13 Å)։ Մոլեկուլը թույլ էլեկտրացված է և ունի μ = 0, 04·10−29 Կլ·մ դիպոլ մոմենտ։ Տարբեր փորձերի արդյունքում ապացուցված է, որ բացասական լիցքը տեղակայված և ածխածնի ատոմի վրա C−←O+։
Հատկություններ
խմբագրելԱծխածնի մոնօքսիդը անգույն, անհամ, անհոտ գազ է։ Դյուրին բռնկվում է։
| Առաջացման Գիպսի էներգիա | −137, 14 կՋ/մոլ |
| Առաջացման էնթրոպիա | 197, 54 կՋ/մոլ·Կ |
| Մոլային ջերմունակություն | 29, 11 կՋ/մոլ·Կ |
| Հալման էնթալպիա | 0, 838 կՋ/մոլ |
| Եռման էնթալպիա | 6, 04 կՋ/մոլ |
| Կրիտիկական ջերմաստիճան | −140, 23 °C |
| Կրիտիկական ճնշում | 3, 499 ՄՊա |
| Կրիտիկական խտություն | 0, 301 գ/սմ 3 |
Այն ռեակցիաները, որոնցում մասնակցում է ածխածնի մոնօքսիդը հիմնականում պատկանում են միացման և օքսիդա-վերականգման տիպին։ Ածխածնի մոնօքսիդը հիմնականում հանդիսանում է վերականգնիչ։ Ածխածնի մոնօքսիդը սենյակային ջերմաստիճանում քիմիապես քիչ ակտիվ է, այն ակտիվ է տաքացնելիս և լուծույթներում։ Այն վերականգնում է ջրածնից ներքև գտնվող մետաղներին իրենց աղերի լուծույթներից (Au, Pt, Pd, Cu)`
- :
830 °C-ից ցածր ջերմաստիճաններում -ն ավելի ուժեղ վերականգնիչ է քան ջրածինը, իսկ 830 °C-ից բարձր ջերմաստիճաններում՝ հակառակը։ Դրա համար
ռեակցիայի հավասարակշռության կենտրոնը տատանվում է կախված ջերմաստիճանից։ Որոշ բակտերիաներ կարողանում են CO-ի օքսիդացումից ստանալ իրենց համար հարկավոր էներգիան`
- :
-ն փոխազդում է հալոգենների հետ։ Ամենակիրառվող ռեակցիան ֆոսգենի ստացումն է՝
- :
-ի և -ի փոխազդեցությունից կարելի է ստանալ ոչ միայն կարբոնիլ ֆտորիդ, այլ նաև պերօքսիդային միացություն : Այն թթվային միջավայրում փոխազդում է կալիումի յոդիդի հետ՝
- :
-ն փոխազդում է խալկոգենների հետ՝
- :
-ն վերականգնում է -ը `
Անցումային մետաղների հետ առաջացնում է թունավոր միացություններ(կարբոնիլներ)`
- :
-ն փոխազդում է ալկալիների հալույթների հետ, առաջացնելով համապատասխան մետաղի ֆորմիատ՝
- :
-ն փոխազդում է մետաղական կալիումի հետ առաջացնելով կալիումի դիօքսօդիկարբոնատ՝
- :
-ն փոխազդում է ամոնիակի հետ առաջացնելով արդյունաբերության համար շատ կարևոր ցիանաջրածնական թթուն (կապտաթթու)`
- :
-ն փոխազդում է ջրածնի հետ առաջացնելով սպիրտներ և գծային ալկաններ (Ֆիշեր-Տրոպսի ռեակցիա)։
Թունավորում ածխածնի մոնօքսիդով
խմբագրելՖիզիոլոգիական ազդեցություններ
խմբագրելՇմոլ գազը շատ թունավոր է որովհետև այն չունի գույն, հոտ։ Այն կարող է առաջացնել թունավորում, նույնիսկ մահ։ Թունվորման պատճառը կարբօքսիհեմոգլոբինի առաջացումն է`
որը ավելի կայուն միացություն է, քան օքսիհեմոգլոբինը(OHem)։ Կարբոքսիհեմոգլոբինի առաջացման հետևանքով դադարում է թթվածնի մատակարարումը բջիջներին։ Եթե սենյակի օդում պարունակվում է 0, 1 % շմոլ գազ, ապա ապա այնտեղ գտնվող մարդը կամահանա մոտ մեկ ժամից։
Օգնությունը թունավորման ժամանակ
խմբագրելԿարբոքսիհեմոգլոբինի առաջացումը դարձելի է։
- Տուժածին պետք է տանել մաքուր օդի միջավայր։ Թեթև թունավորման ժամանակ կարելի է ընդամենը կատարել թոքերի հիպերօդափոխում։
- Թոքերի արհեստական օդափոխում։
- Լոբեին կամ կոֆեին մաշկի տակ։
- Ներերակային կարբօքսիլազա։
- Ներմկանային ացիզոլ։
Թունավորման կանխարգելումը
խմբագրելԱկտիվ ածխի կողմից ածխածնի մոնօքսիդը շատ քիչ է կլանվում, դրա համար օգտագործվում են հակագազեր ուրիշ ակտիվ տարրով՝ հիպոկալիտային փամփուշտ։ Հիպոկալիտը կատալիզատոր է, որի վրա տեղի է ունենում CO-ի օսքիդացում մինչև CO2։
Բացահայտման պատմություն
խմբագրելԱծխի այրումից առաջացած ծուխի թունավոր հատկությունը նկարագրել էին դեռ Արիստոտելը և Հալենը։ Ածխածնի մոնոքսիդը առաջին անագամ ստացել է Ժակ դե Լասսոն 1776 թվականին, ցինկի օքսիդի և ածխածնի տաքացումից, սակայն անջատված գազը վառվում էր կապույտ գույնով դրա համար էլ այն խառնեցին ջրածնի հետ։
Գազի բաղադրությունը հայտնաբերել է 1800 թվականին Վիլիամ Կրուկշեինկը։ Գազի թունավոր հատկությունը ուսումնասիրել է Կլոդ Բեռնարը, փորձարկելով շների վրա։ Երկրի մթնոլորտից դուրս CO հայտնաբերել է Մ. Միժոտը 1949 թվականին, ուսումնասիրելով արեգակի ԻԿ սպեկտորը։
Ստացում
խմբագրելԱրդյունաբերական եղանակ
խմբագրել- Առաջանում է ածխածնի կամ ածխածին պարունակող միացությունների թերայրումից՝
- Առաջանում է CO2-ի վերականգնումից (շիկացած ածխով)`
- :
Այս ռեակցիան դարձելի է։ Ջերմաստիճանի ազդեցությունը ռեակցիաի վրա պատկերված է գրաֆիկում։ Այս հավասարակշռությունը կոչվում է Բուդուառաի հավասարակշռություն։
- Ածխածնի մոնօքսիդի խառնուրդները ստանում են ջրային գոլորշիները, օդը (և նման) շիկացած կոքսի վրայով անցկացնելիս։
Լաբորատոր եղանակ
խմբագրել- Ստանում են հեղուկ մրջնաթթվի քայքայումից օգտագործելով կամ
- :
Կարելի է նաև մրջնաթթուն մշակել քլորսուլֆիտային թթվով`
- Օքսալաթթվի և կոնցենտրիկ ծծմբական թթվի տաքացումից՝
- Կարմիր արյան աղի և կոնցենտրիկ ծծմբական թթվի տաքացումից՝
- :
- Ցինկի կարբոնատը մագնեզիումով վերականգնելիս՝
- :
Ածխածնի մոնօքսիդի քանակական և որակական անալիզը
խմբագրել-ի որակական բաղադրությունը կարելի է հայտնաբերել պալադիումի քլորիդի լուծույթով։ Այն սկսում է սևանալ։ Դա ռեակցիայի արդյունքում նստող պալադիումն է։
- :
Այս ռեակցիան իրականացնելու համար պետք է 1 գրամ պալադիումի քլորիդը լուծել 1 լիտր ջրում։ Քանակական բաղադրությունը ստանալու համար օգտվում են յոդոմետրիկ եղանակից՝
- :
Կիրառություն
խմբագրել- -ն հանդիսանում է միջանկյալ նյութ, որը մցնում են ջրածնի հետ ռեակցիայի մեջ խոշոր արդյունաբերական նպատակներով՝ սպիրտների և չճյուղավորված ածխաջրածինների ստացման համար։
- -ն օգտագործում են կենդանիների, թռչունների և ձկների միսը մշակելու համար։ Այն տալիս է նրանց թարմ մսի գույն առանց համը փոխելու (տեխնալոգիաէ en:Clear smoke կամ en:Tasteless smoke)։
- Այն հանդիսանում է գեներատորային գազի հիմնական բաղադրամասը, որը օգտագործվում է գազագեներատորային մեքենաներում։
- Ավտոմեքենաների արտանետած գազի մեջ գտնվող -ն օգտագործվել է որպես թունանյութ երկրորդ համաշխարհային պատերազմի ժամանակ՝ ֆաշիստների կողմից։
- Օգտագործվում է գազային խցիկներում։
- Օգտագործվել է Գազենվագեններում։
Ածխածնի մոնօքսիդը երկրի մթնոլորտում
խմբագրելՏարբերում են -ի առաջացման երկու ձև՝
- Բնական
- Անթրոպոգեն (մարդու գործունությունից առաջացած)
Նորմալ պայմաններում, երկրի վրա առաջանում է օրգանական միացությունների ոչ լրիվ անաէրոբ քայքայումից և կենսազանգվածի այրումից, հիմնականում անտառների այրումից։ Հողում առաջանում է ինչպես բնական, այնպես էլ ոչ բնական ճանապարհներով։ Փորձնականորեն ապացուցված է, որ հողում առաջանում է ֆենոլային միացությունների շնորհիվ, որոնք պարունակում են կամ խմբեր՝ պարա կամ օրթո իզոմերների ձևով։ Մթնոլորտում -ն հանդիսանում է շղթայական ռեակցիաների արդյունք, որոնցում մասնակցում են մեթան և այլ ածխաջրածիններ (առաջին հերթին իզոպրեն)։
Գրականություն
խմբագրել- Ахметов Н. С. Общая и неорганическая химия. 5-е изд., испр. - М.: Высш. шк.; 2003
- Некрасов Б. В. Основы общей химии. Т. I, изд. 3-е, испр. и доп. Изд-во «Химия», 1973 г. Стр. 495-497, 511-513
- Химия: Справ. из./В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Перс. с нем. 2-е изд., стереотип. - М.:Химия, 2000
- Баратов А. Н. Пожаровзрывоопасность веществ и материалов и средства их тушения: Справочное издание: в 2-х книгах; Книга 2. - М.: Химия, 1990 - 384с.
Ծանոթագրություններ
խմբագրել- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 http://www.cdc.gov/niosh/npg/npgd0105.html
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 David R. Lide, Jr. Basic laboratory and industrial chemicals: A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ http://dic.academic.ru քիմիական տեղեկագիրք
Արտաքին հղումներ
խմբագրել| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ածխածնի մոնօքսիդ» հոդվածին։ |
| Այս հոդվածն ընտրվել է Հայերեն Վիքիպեդիայի օրվա հոդված: |