Նատրիումի կարբոնատ
Նատրիումի կարբոնատ (կալցինացված սոդա, ածխաթթվի նատրիումական աղ)՝ անօրգանական միացություն է։ Քիմիական բանաձևը՝ է։ Ջրում լավ լուծվող, խոնավածուծ, անգույն բյուրեղային նյութ է կամ սպիտակ փոշի։ Արդյունաբերության մեջ հիմնականում ստանում են նատրիումի քլորիդից Սոլվեի եղանակով։ Կիրառվում է ապակու, լվացող միջոցների արտադրություններում, բոքսիտներից ալյումինի ստացման և նավթի մաքրման ժամանակ։
| Նատրիումի կարբոնատ | |
|---|---|
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | Նատրիումի կարբոնատ |
| Քիմիական բանաձև | CNa₂O₃, Na₂CO₃ |
| Մոլային զանգված | 1,8E−25 կիլոգրամ[1] գ/մոլ |
| Խտություն | 2,53 գ/սմ³ գ/սմ³ |
| Հալման ջերմաստիճան | 852 °C և 858,1 °C[2] °C |
| Կազմալուծման ջերմաստիճան | 1000 °C |
| Քիմիական հատկություններ | |
| pKa | 10,33 |
| Դասակարգում | |
| CAS համար | 497-19-8 |
| PubChem | 10340, 516885 |
| EINECS համար | 207-838-8 |
| SMILES | C(=O)([O-])[O-].[Na+].[Na+] |
| ЕС | 207-838-8 |
| RTECS | VZ4050000 |
| ChEBI | 9916 |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Ֆիզիկական հատկություններ
խմբագրելԱնգույն բյուրեղային նյութ է կամ սպիտակ փոշի։ Ունի մի քանի ձևափոխություններ։ -ձևափոխությունը ձևավորվում է 350 °C-ում, ապա մինչև 479 °C տաքացնելիս առաջանում է -ձևափոխությունը։ - և -ձևափոխությունն ունեն մոնոկլինային խորանարդային բյուրեղացանցեր։ 479 °C-ից բարձր ջերմաստիճանում նատրիումի կարբոնատը վերածվում է վեցանկյուն բյուրեղացանց ունեցող -ձևափոխության։ Հալվում է 854 °C-ում, 1000 °C-ից բարձր ջերմաստիճանում քայքայվում է առաջացնելով նատրիումի օքսիդ և ածխաթթու գազ[3][4]։
Անգույն, մոնոկլինային բանաձևով բյուրեղահիդրատը 32,017 °C-ում վերածվում է շեղանկյուն բյուրեղացանցով բյուրեղահիդրատի, մինչև 35,27 °C տաքացնելիս վերածվում է անգույն շեղանկյուն բյուրեղացանցով բյուրեղահիդրատի։ 100-200 °C-ում մոնոհիդրատը կորցնում է ջուրը վերածվելով՝ :
Պատկերասրահ
խմբագրել-
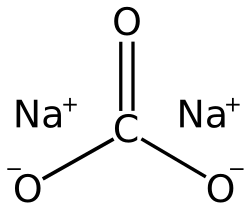
Նատրիումի կարբոնատի մոլեկուլի կառուցվածքը:
-
Նատրիումի կարբոնատի խորանարդային բյուրեղացանց:
| Ֆիզիկական մեծություն | անջուր նատրիումի կարբոնատ | դեկահիդրատ |
|---|---|---|
| մոլեկուլային զանգված | 105,99 զ. ա. մ. | 286,14 զ. ա. մ. |
| հալման ջերմաստիճան | 854 °C | 32 °C |
| լուծելիություն | չի լուծվում ացետոնում և ծծմբածխածնում, քիչ լուծելի է էթանոլում, լավ է լուծվում գլիցերինում և ջրում | |
| խտություն | 2,53 գ/սմ³ (20 °C-ում) | 1,446 գ/սմ³ (17 °C-ում) |
| գոյացման ստանդարտ էնթալպիա ΔH | −1131 ԿՋ/մոլ (297 Կ-ում) | −4083,5 ԿՋ/մոլ (297 Կ-ում) |
| գոյացման ստանդարտ Գիբսի էներգիա G | −1047,5ԿՋ/մոլ (297 Կ-ում) | −3242,3 ԿՋ/մոլ (297 Կ-ում) |
| գոյացման ստանդարտ էնթրոպիա S | 136,4 ԿՋ/մոլ·Կ (297 Կ-ում) | |
| ստանդարտ մոլային ջերմունակություն Cp | 109,2 ԿՋ/մոլ·Կ (297 Կ) |
| ջերմաստիճան, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| լուծելիություն, գ 100 գ | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
Բնության մեջ
խմբագրելԲնության մեջ սոդան հանդիպում է որոշ ծովային ջրիմուռների մոխրի բաղադրության մեջ, ինչպես նաև առանձին հանքերի տեսքով՝
- նախկոլիտ
- տրոն (եգիպտական աղ)
- նատրիտ (նատրոն, բյուրեղային սոդա)
- թերմոնատրիտ
Ժամանակակից սոդայի լճերը հայտնի են Անդրբայկալում և Արևմտյան Սիբիրում, մեծ ճանաչում ունեն Նատրոն լիճը Տանզանիայում և Սիրլիս լիճը Կալիֆորնիայում[5]։ Արդյունաբերական նշանակություն ունեցող տրոնը հայտնաբերվել է 1938 թվականին Գրին-Ռիվերում՝ (Վայոմինգ, ԱՄՆ) էոցենի շերտում։ Այս նստվածքային շերտում հայտնաբերվել են նաև նախկինում հազվագյուտ համարվող հանքեր, այդ թվում դավսոնիտը, որը հումք է հանդիսանում սոդայի և ալյումինի օքսիդի ստացման համար։ ԱՄՆ-ում բնական սոդան բավարարում է այս հանքանյութի նկատմամբ երկրի պահանջարկի ավելի քան 40%-ը։
Քիմիական հատկություններ
խմբագրելՆատրիումի կարբոնատը ջրային լուծույթում հիդրոլիզվում է ապահովելով միջավայրի հիմնային ռեակցիան։ Նատրիումի կարբոնատի հիդրոլիզի կրճատ իոնային հավասարումն է՝
Ածխաթթվի դիսոցման հաստատունը առաջին փուլի համար 4,5×10−7 է։ Ածխաթթուն անկայուն և թույլ թթու է։ Նատրիումի կարբոնատի և թթուների փոխազդեցությունից առաջանում է ածխաթթու, որն անմիջապես քայքայվում է վերածվելով ածխածնի երկօքսիդի և ջրի։
Ստացում
խմբագրելՄինչև 19-րդ դարի սկիզբը, նատրիումի կարբոնատը ստացվում էր հիմնականում որոշ ջրիմուռների, ափամերձ և աղասեր բույսերի մոխրից վերաբյուրեղացման միջոցով։
Լեբլանի եղանակ
խմբագրել1791 թվականին ֆրանսիացի քիմիկոս Նիկոլայ Լեբլանը «Գլաուբերի աղը սոդայի վերափոխելու մեթոդի» համար արտոնագիր ստացավ։ Նատրիումի սուլֆատի («Գլաուբերի աղ»), կավիճի կամ կրաքարի (կալցիումի կարբոնատ) և փայտածուխի խառնուրդը եփվում է մոտ 1000 °C ջերմաստիճանում։ Ածուխը նատրիումի սուլֆատը վերականգնում է մինչև նատրիումի սուլֆիդի։
Նատրիումի սուլֆիդը փոխազդում է կալցիումի կարբոնատի հետ։
Ստացված հալույթը մշակում են ջրով, նատրիումի կարբոնատը անցնում է լուծույթ, կալցիումի սուլֆիդը ֆիլտրում են, ապա նատրիումի կարբոնատի լուծույթը շոգիացնում։ Ստացված նատրիումի կարբոնատը վերաբյուրեղացնում են։ Լեբլանի եղանակով ստացվում է նատրիումի կարբոնատի բյուրեղահիդրատ։ Ստացված սոդան ջրազրկում են կալցինացման եղանակով։
Նատրիումի սուլֆատը ստացվում է կերակրի աղի և ծծմբական թթվի փոխազդեցությունից։
Ռեակցիայի հետևանքով անջատվող քլորաջրածինը կլանում են ջրով ստանալով աղաթթու։
Ռուսաստանում այս տիպի առաջին գործարանը հիմնադրվել է Բառնաուլում 1864 թվականին՝ արդյունաբերող Մ. Պրանգի կողմից։
Սոլվեի խնայողական և տեխնոլոգիական մեթոդի հայտնվելուց հետո (որի արդյունքում մեծ քանակով կողմնակի կալցիումի սուլֆիդ չի առաջանում) Լեբլանի եղանակով աշխատող գործարանները փակվեցին։ 1900 թվականին գործարանների 90 %-ը աշխատում էին Սոլվեի եղանակով։ Լեբլանի եղանակով աշխատող վերջին ֆաբրիկան փակվեց 1920-ական թվականների սկզբին։
Սոլվեի եղանակ (արդյունաբերական ամոնիակային եղանակ)
խմբագրել1861 թվականին բելգիացի ինժեներ-քիմիկոս Էռնեստ Սոլվեն արտոնագրեց սոդայի արտադրության իր եղանակը, որը կիրառվում է մինչ օրս։
Նատրիումի քլորիդի հագեցած լուծույթի միջով անցկացնում են գազային ամոնիակ և ածխածնի (IV) օքսիդ, կարծես թե լուծույթը մշակում են ամոնիումի կարբոնատով՝ :
Քիչ լուծելի նատրիումի հիդրոկարբոնատի մնացորդը ֆիլտրում են և կալցինացնում (ջրածնազրկում՝ տաքացնելով 140-160 °C), որի արդյունքում հիդրոկարբոնատը վերածվում է կարբոնատի։
Անջատված վերադարձնում են արդյունաբերական ցիկլ։ Ամոնիումի քլորիդը՝ մշակում են կալցիումի հիդրօքսիդով՝ :
Ստացված -ը ևս վերադարձնում են արդյունաբերական ցիկլ։
Այսպիսով, գործընթացի միակ թափոն համարվում է կալցիումի քլորիդը։
Սոդայի ստացման այս եղանակով աշխատող աշխարհում առաջին գործարանը բացվել է 1863 թվականին Բելգիայում, Իսկ Ռուսաստանում՝ 1883 թվականին Ուրալի մարզի Բերեզնիկի քաղաքում։ «Լյուբիմով, Սոլվե և Ընկ.» գործարանը տարեկան արտադրում էր 20 տ սոդա։
Մինչ օրս այս եղանակը հանդիսանում է սոդայի ստացման հիմնական եղանակ։
Հոուի եղանակ
խմբագրելԵղանակը մշակվել է 1930 թվականին Հոուի (Hou Debang) կողմից։ Սոլվեի եղանակից տարբերվում է նրանով, որ չի օգտագործվում կալցիումի հիդրօքսիդ։
Հոուի եղանակով ածխածնի երկօքսիդը և ամոնիակը նատրիումի քլորիդի լուծույթով անցկացնում են 40 °C-ում։ Ինչպես Սոլվեի եղանակում, այստեղ ևս քիչ լուծված նատրիումի հիդրոկարբոնատը նստեցվում է, ապա լուծույթը մինչև 10 °C սառեցնելով նստեցվում է ամոնիումի քլորիդը, իսկ լուծույթը օգտագործվում է սոդայի հաջորդ խմբաքանակի ստացման համար։
Ստացման եղանակների համեմատում
խմբագրելՆատրիումի կաբոնատի ստացման Հոուի եղանակով որպես կողմնակի նյութ ստացվում է NH4Cl, իսկ Սոլվեյի եղանակում՝ CaCl2:
Սոլվեի եղանակը մշակվել է նախքան Հաբերի եղանակի ի հայտ գալը։ Այդ ժամանակ ամոնիակի քանակը քիչ էր։ Դրա համար էլ ամոնիումի քլորիդից ամոնիակի վերականգնումը անհրաժեշտություն էր։ Հոուի եղանակը ավելի ուշ է հայտնվել, ամոնիակի վերականգնումը և դուրս բերումը խիստ կարևոր չէր։ Ստացված ամոնիումի քլորիդը օգտագործվել է որպես ազոտական պարարտանյութ։
Սակայն ամոնիումի քլորիդը պարունակում է քլոր, որի ավելցուկը վտանգավոր է շատ բույսերի համար, ուստի որպես պարարտանյութ ամոնիումի քլորիդի կիրառումը սահմանափակ է։ Չինաստանում այս եղանակներից ավելի շատ տարածված է Հոուի եղանակը, քանի որ ստացված ամոնիումի քլորիդը որպես պարարտանյութ կիրառվում է բրնձաբուծության մեջ (քլորի ավելցուկը նպաստում է բրնձի աճին)։
Այժմ մի շարք երկրներում արդյունաբերության մեջ նատրիումի կարբոնատի մեծ մասը ստացվում է Սոլվեի եղանակով (ներառյալ Հոուի եղանակը որպես Սոլվեի եղանակի ձևափոխություն)։ 2000 թվականի տվյալներով Եվրոպայում արդյունաբերական նատրիումի կարբոնատի 94% այս եղանակով են ստանում, իսկ ամբողջ աշխարհում՝ 84%-ը[6]։
Կիրառություն
խմբագրելՆատրիումի կարբոնատը կիրառվում է ապակու արտադրությունում, օճառի, լվացքի և մաքրող փոշիների, էմալի, ուլտրամարինի (վառ կապույտ ներկ, ծովազվարթ) արտադրությունում։ Կիրառվում է նաև ջրի կոշտության վերացման, մետաղների ճարպազերծման համար և թուջի արտադրությունում։
Նատրիումի կարբոնատը ելանյութ է հանդիսանում , նյութերի ստացման համար։ Կարող է կիրառվել ծխախոտի ֆիլտրի արտադրությունում[7]։
Սննդի արդյունաբերությունում նատրիումի կարբոնատները գրանցված են որպես սննդային հավելումներ՝ E500 թթվայնության կարգավորիչ, փխրեցուցիչ։ Նատրիումի կարբոնատը (կալցինացված սոդան՝ ) ունի 500i կոդը, նատրիումի հիդրոկարբոնատը՝ 500ii (խմելու սոդա՝ ) և նատրիումի կարբոնատի և հիդրոկարբոնատի խառնուրդը՝ 500iii:
Ժամանակակից նավթարդյունաբերության մեջ նատրիումի կարբոնատը օգտագործվում է ջրի և նավթի միջֆազային լարվածությունը նվազեցնելու համար։
Կիրառվում է լուսանկարչության մեջ երևակչի բաղադրությունում որպես արագացուցիչ[8]։
Պոլիմերացումը կանխելու համար ավելացվում է շարժիչի յուղի բաղադրության մեջ։
Անվտանգություն
խմբագրելԱրդյունաբերական շինություններում օդում կալցինացված սոդայի սահմանային թույլատրելի կոնցենտրացիան 2մգ/մ է[3]։ Կալցինացված սոդան դասվում է 3-րդ կարգի վտանգավոր նյութերի շարքին։ Կալցինացված սոդայի աէրոզոլը խոնավ մաշկի վրա, աչքի լորձաթաղանթում և քթում հայտնվելիս կարող է գրգռվածություն առաջացնել, իսկ դրա երկարատև ազդեցությունը առաջացնում է մաշկաբորբ (դերմատիտ)։
Պատահական անուններ
խմբագրելՍոդան ածխաթթվի նատրիումական աղի տեխնիկական անվանումն է։
- (Նատրիումի կարբոնատ) — կալցինացված սոդա, սպիտակեղենի սոդա
- (նատրիումի կարբոնատի հիդրատ, պարունակում է 62,5 % բյուրեղաջուր)՝ լվացքի սոդա, երբեմն թողարկվում է կամ տեսքով։
- (նատրիումի հիդրոկարբոնատ) — խմելու սոդա, սննդի սոդա, նատրիումի բիկարբոնատ։
Գրականություն
խմբագրել- Гурлев Д.С Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
- Рукк Н. С. Натрия карбонат // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди—Полимерные.
Ծանոթագրություններ
խմբագրել- ↑ 1,0 1,1 SODIUM CARBONATE
- ↑ 2,0 2,1 David R. Lide, Jr. Basic laboratory and industrial chemicals: A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 3,0 3,1 Рукк, 1992
- ↑ Аликберова
- ↑ https://books.google.am/books?id=p4p0DQAAQBAJ&pg=PT5&lpg=PT5&dq=%D0%BE%D0%B7%D0%B5%D1%80%D0%BE+%D0%A1%D0%B8%D1%80%D0%BB%D1%81+%D0%B2+%D0%9A%D0%B0%D0%BB%D0%B8%D1%84%D0%BE%D1%80%D0%BD%D0%B8%D0%B8.&source=bl&ots=L9JFwBw9I9&sig=ACfU3U2QQGTyDReRRJ-TMQ-NJhbBAPIq-w&hl=ru&sa=X&ved=2ahUKEwj-oubK_5zgAhUKKywKHQzTC8oQ6AEwBXoECAMQAQ#v=onepage&q=%D0%BE%D0%B7%D0%B5%D1%80%D0%BE%20%D0%A1%D0%B8%D1%80%D0%BB%D1%81%20%D0%B2%20%D0%9A%D0%B0%D0%BB%D0%B8%D1%84%D0%BE%D1%80%D0%BD%D0%B8%D0%B8.&f=false
- ↑ «WebCite query result» (PDF). Արխիվացված է օրիգինալից (PDF) 2008 թ․ ապրիլի 7-ին. Վերցված է 2008 թ․ մարտի 1-ին.
{{cite web}}: Cite uses generic title (օգնություն); More than one of|archivedate=and|archive-date=specified (օգնություն); More than one of|archiveurl=and|archive-url=specified (օգնություն) - ↑ «Патент на изобретение». Արխիվացված է օրիգինալից 2014 թ․ հուլիսի 8-ին. Վերցված է 2013 թ․ հոկտեմբերի 6-ին.
- ↑ Гурлев, 1988, էջ 298
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Նատրիումի կարբոնատ» հոդվածին։ |
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 8, էջ 199)։ |
